「は?」ってなった人の「は?」を少しでも解消したいのでこの記事で結構真剣に解説したいと思います。
芳香属性を示す条件
・環を構成する原子がすべてsp2混成をしている(同一平面にある)
・π電子の数が合計4n+2個存在する
この条件を満たすとき、その化合物は芳香族性を示し、予想されるよりも安定化します。
窒素の電子配置
ピロールの混成軌道
構造からわかるように、ピロールは環内に二重結合を2つもちます。二重結合1つあたりπ電子は2つあると考えてよいので、ピロールのπ電子数は4個です。(?)
さて、本当にそうでしょうか。窒素原子の電子はどのようになっているのでしょうか。考えてみましょう。
窒素は3つの原子と結合していますね。アンモニアなどの例を考えると、この場合、sp3混成をしているのではないかと予想すると思います。
sp3混成をした場合の窒素の電子配置はこんな感じになるでしょう。
これはまさにアンモニアNH3が作られるときの電子配置と同じで、sp3軌道に非共有電子対が一組存在していますね。
このような混成をした場合、もちろん、ピロールは芳香属性を示しません。
しかし、仮に、sp2混成したとしたらどうでしょうか。sp2混成した場合の窒素の電子配置はこんな感じです。
窒素の場合、電子の配置に関してのみ言えば、sp2混成とsp3混成の違いは、非共有電子対がsp3軌道に存在するかp軌道に存在するかだけですね。
どちらの混成をしても、3つの原子と結合することができるわけです。
では、どちらの混成をするのでしょうか。答えはsp2混成です。
なぜなら、sp2混成をすれば、p軌道の電子はπ電子と振る舞うことができ、芳香属性を満たすことにより安定化するからです。
p軌道の電子がπ電子として振る舞うというところに疑問を抱く人もいると思うので、軌道の立体的な形について少し説明しておきます。
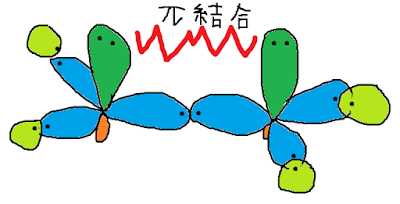
sp2混成すると、その軌道の形は正三角形になります。そのsp2軌道とp軌道の立体的な配置はこの図のようになります。
この図の青色の部分がsp2混成軌道で、緑とオレンジが合わせてひとつのp軌道です。
ところで、二重結合のπ結合はどのような結合をしていたでしょうか。
アセチレンを思い出すと、このような形をしていましたね。
つまり、図から、窒素原子のp軌道は二重結合のπ結合の位置と同じところに突き出ていることがわかります。よって、p軌道の非共有電子対はπ電子として働きます。
以上の理由より、ピロールは芳香属性を示すと考えることができます。